В данной статье рассматривается влияние старения на стволовые клетки в разных тканях. Недавние исследования были посвящены механизмам, посредством которых генетические мутации, эпигенетические изменения и внешняя среда оказывают влияние на функциональность стволовых клеток с течение времени. Авторы описывают каждый из этих трех факторов, механизмы их взаимодействия, а также то, каким образом эти взаимодействия со временем ухудшают состояние стволовых клеток. Авторы оптимистично считают, что лучшее понимание этих изменений откроет потенциальные стратегии улучшения функциональности стволовых клеток и повышения жизнеспособности тканей в пожилом возрасте.
Процесс старения остается одной из основных загадок биологии, как с эволюционной (почему мы стареем), так и с механистической перспективы (как мы стареем). Старение организма является отказом интегрированной системы, уравновешивающим генетические программы выживания и размножения. Согласно теории «одноразовой сомы» (1), доступные организму ресурсы расходуются либо на выживание, либо на размножение, так как оба эти фактора необходимы для выживания вида, эволюционирующего в дикой природе. Однако в условиях защиты от внешних причин смертности (таких как хищничество, голод и другие опасные для жизни воздействия), как в случае современного Homo sapiens, а также животных, живущих на фермах, в зоопарках и в лабораториях, в игру вступают дополнительные факторы. В таких случаях представители видов с большей вероятностью живут дольше по сравнению со своими собратьями в дикой среде обитания, что позволяет проявляться фенотипам старения и возрастным болезням, которые реже или вообще не манифестируют в природных условиях. Этот феномен рассматривается как «защищенное старение».
Одним из основных параметров защищенного старения является увеличенная выживаемость после достижения возраста пика репродуктивной способности (рисунок 1). Тот факт, что представители любых видов редко переживают эту стадию в дикой природе, указывает на отсутствие эволюционного давления, направленного на отбор генетических механизмов, обеспечивающих поддержание соматических тканей в преклонном возрасте. Таким образом можно предположить, что необходимые для поддержания функционального на протяжении всей жизни механизмы со временем утрачивают надежность. Более того, со временем у большинства видов по достижении репродуктивной зрелости подавляющие рост механизмы начинают преобладать на механизмами, стимулирующими рост. Этот критичный переходный момент и сохранение преобладания подавляющих рост механизмов по выходу из него в большой вероятностью ответственны за прогрессивную деградацию функциональности тканей, характерную для защищенного старения. В таком виде то, что принято называть «старением», представляет собой комбинацию постепенного отказа системы, подогнанной под ранний рост и репродуктивную способность, с кумулятивными эффектами подавляющих рост механизмов и приобретенных соматических повреждений. Модулирование любого аспекта этой системы потенциально способно ускорить или замедлить процесс старения.

Рисунок 1. Модель использования стволовых клеток на протяжении жизни. В процессе эмбриогенеза и роста организма стволовые клетки отличаются высокой активностью и участвуют в формировании и росте тканей. В основной репродуктивной фазе происходит подавление роста. Стволовые клетки обновляют ткани и восстанавливают их повреждения. Характеристики стволовых клеток на протяжении этих двух первых фаз были бы подвержены силам естественного отбора, так как эти фазы выживания и репродукции были бы критичными для сохранения вида. По завершении периода репродуктивной зрелости, после угасания способности к воспроизведению, что также соответствует периоду «защищенного старения», функционирование клеток и тканей предположительно мало или вообще не подвергается эволюционному давлению по двум причинам: так как они уже не важны для выживания вида и также потому, что в дикой природе выживаемость по достижении этой фазы значительно снижается. Именно на протяжении этой фазы происходит снижение функциональности (но совсем не обязательно количества) стволовых клеток в большинстве тканей, в некоторых случаях это происходит очень резко.
Способность организма поддерживать здоровое функционирование на протяжении взрослой жизни зависит от гомеостатических механизмов. Во многих органах зрелых позвоночных резидентные стволовые клетки участвуют с обновлении ткани и регенерации после повреждений, с вариациями этих ролей между разными тканями. Например, нервные стволовые клетки (НСК) важны для текущего формирования новых нейронов в определенных регионах головного мозга, однако играют ограниченную роль в восстановлении повреждений. Напротив, стволовые клетки скелетной мускулатуры (или сателлитные клетки) играют минимальную роль в обновлении ткани, однако очень активно участвуют в восстановлении повреждений. Гемопоэтически стволовые клетки (ГСК) и стволовые клетки кишечника выполняют обе функции, участвуя в непрерывной продукции дифференцированных клеток и восстанавливая ткани после повреждения.
При защищенном старение степень, до которой стволовые клетки продолжают обновлять соответствующие ткани зависит от их собственного состояния. Несмотря на то, что стволовые клетки обладают характеристиками (таким как скорость обновления, специализированная ниша), способными защитить их от ассоциированными с возрастом губительными воздействиями, имеющиеся данные свидетельствуют о возрастном ухудшении состояния стволовых клеток (2). Более того, любые нарушения стволовых клеток могут передаваться их дифференцированным потомкам, что способствует старению ткани. По сути открытыми остаются вопросы о том, насколько эффективно популяции стволовых клеток поддерживают состояние здоровья ткани, каковы ограничения этой способности и какие механизмы в конечном итоге ведут к угасанию функциональности стволовых клеток. Изучение стволовых клеток и старение направлено на поиск ответов на эти вопросы, при этом одна из долгосрочных целей заключается в поддержании или восстановлении характерных для молодого возраста характеристик стареющих соматических клеток для обеспечения здорового старения тканей. Данная статья посвящена трем основным направлениям последних исследований в области старения стволовых клеток: генетическим мутациям, эпигенетическим изменениям и внешним факторам. Авторы также рассматривают то, как эти факторы взаимосвязаны между собой и также как модулирование этих факторов в будущем поможет нам улучшать функциональность стволовых клеток и повышать жизнеспособность тканей в пожилом возрасте.
Соматические мутации, стволовые клетки и возраст
В течение десятилетий мы понимали, что повреждающее действие окружающей среды, такое как воздействие ионизирующего излучения и ксенобиотиков, ведет к накоплению соматических мутаций в различных тканях. Эта концепция взята за основу взглядов о повышенной частоте развития рака в преклонном возрасте. Однако остается неясным, каким образом накопление соматических мутаций влияет на старение организма и старение стволовых клеток. Недавнее исследование, посвященное изучению системы гемопоэза, пролило первые лучи света на эти вопросы.
Если соматически приобретенные мутации редки, большинство клеток периферической крови должны иметь идентичную геномную последовательность, поэтому кровь можно использовать для оценки «зародышевого статуса» генетического материала человека. Однако исследования вызывающих развитие лейкемии мутаций с использованием метода глубокого секвенирования генома показали, что нормальные клетки крови являются носителями
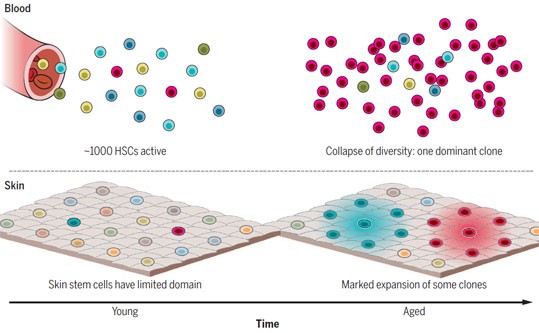
Рисунок 2. Разнообразие и динамика стволовых клеток по мере старения. Вверху: Клетки периферической крови молодых индивидуумов производятся примерно 1 000 активных стволовых клеток. К 70 годам разнообразие клонов радикально снижается, что приводит к доминированию одного клона гемопоэтических стволовых клеток, в результате чего примерно у 20% людей один клон отвечает за продукцию 20–80% клеток крови. Внизу: Схематичное изображение поверхности кожи. Молодая кожа непрерывно обновляется за счет стволовых клеток, каждая из которых отвечает за строго ограниченный домен (обозначено кружками). Случайные мутации приводят к незначительным вариациям поверхности кожи в отношении стволовых клеток и их потомков (окрашенные кружки). Со временем некоторые клоны значительно разрастаются, что приводит к появлению сформированных клонами участков кожи, клетки которых несут общие наборы генетических вариантов (18).
Представление о клональном коллапсе перевернуло взгляды на возрастную динамику гемопоэтических стволовых клеток и породило большой интерес к пониманию потенциальных механизмов этого феномена. Одна подсказка была получена при изучении генов, наиболее часто мутирующих в данных крупных клонах. Мутации примерно 20 генов часто ассоциированы с клональным гемопоэзом. Наиболее важные из них — DNMT3A и TET2 — являются эпигенетическими регуляторами, регулирующими статус метилирования ДНК. Оба гена часто мутируют при многих гематологических злокачественных заболеваниях, а их утрата ведет к увеличению количества стволовых клеток и
При совместном рассмотрении данные, полученные в экспериментах на мышах и с участием человека, указывают на то, что приобретенные соматические мутации могут обеспечивать стволовыми
Существуют ли доказательства ассоциированной с возрастом клональной экспансии стволовых клеток в других тканях и влияет ли это на здоровье ткани? Данный феномен, хотя и не изученный в большом масштабе, имеет место и в других тканях. Например, стволовые клетки в целом ответственны за производство дифференцированных эпителиальных клеток на очень ограниченных участках поверхности кожи. Однако в нормально стареющей коже, подверженной воздействию солнечных лучей, выраженная экспансия клонов, ассоциированная с определенными мутациями, в том числе мутациями генов TP53 и регулятора стволовых клеток NOTCH1, проявляется далеко за пределами этих исходных границ (18). Примечательно что почти 20% клеток кожи имеют эти мощные стимулирующие экспансию мутации NOTCH1. Сравнительно низкая частота развития рака, несмотря на высокую частоту клонов, имеющих ассоциированные с раком мутации, является достижением механизмов, препятствующих озлокачествлению. Эффекты, оказываемые этими разросшимися мутантными клонами на возрастные изменения функционирования ткани (в том числе важнейшую барьерную функцию кожи), а также на здоровье организма в целом неясны, однако, учитывая выраженное сходство с клональным коллапсом гемопоэтической системы, нуждаются в дальнейшем изучении.
Вместе эти и другие исследования демонстрируют, что возникающие в стволовых клетках соматические мутации наделяют эти клетки преимуществами, ведущими к их экспансии в ткани в течение многих лет. Многие из этих часто выявляемых соматических мутаций ассоциированы с раком, что может лежать в основе корреляции между частотой развития тканеспецифичных типов рака и пролиферацией стволовых клеток (19). Что более важно, ожидаемо, что клональное доминирование в крови и, возможно, в других тканях может оказывать выраженное влияние на здоровое старение соответствующих тканей.
Эпигенетическая эрозия с возрастом
Понятие эпигенетической регуляции распространяется на механизмы, преимущественно метилирование ДНК и модификации гистонов, обеспечивающие экспрессию одних и подавляющие экспрессию других регионов генома. Существует большой интерес к тому, до какой степени эрозия их имеющих полногеномный масштаб регуляторных механизмов ведет к нарушению регуляторного контроля на экспрессией генов, способствуя возрастному угасанию функций стволовых клеток и тканей. Полученные на модельных организмах генетические доказательства поддерживают точку зрения, согласно которой измененная эпигенетическая регуляция влияет на старение организма. Например, генетический скрининг круглых червей Caenorhabditis elegans выявил, что утрата функции гена Wdr5, кодирующего фермент метилтрансферазу, обеспечивающий триметилирование
Как эти и другие наблюдения касаются старения стволовых клеток млекопитающих? Несмотря на то, что существующие данные недостаточно глубоко проанализированы, они подтверждают концепцию, согласно которой эпигенетическая регуляция в стареющих стволовых клетках подвергается эрозии. В соответствии с полученными на C.elegans данными, существует тенденция к повышению уровня H3K4me3 в стареющих гемопоэтических стволовых клетках, что в особенности распространяется на гены, вовлеченные в поддержание принадлежности этих клеток (23). Как в гемопоэтических, так и в мышечных стволовых клетках уровни репрессивной метки H3K27me3 повышаются с возрастом (23, 24). В гемопоэтических стволовых клетках это повышение ассоциировано с репрессией ряда генов, направляющих специфичные программы дифференцировки, такие как дифференцировка клеток лимфоидного ряда, заведомо угасающая с возрастом. В мышечных стволовых клетках это увеличение ассоциировано с репрессией генов, кодирующих сами гистоны (24). Это наблюдение представляет большой интерес
И наконец, возрастные изменения метилирования ДНК изучались на гемпоэтических стволовых клетках. Уровень метилирования ДНК снижался для генов, ассоциированных с обеспечением самообновления, и повышался вокруг генов, ассоциированных с дифференцировкой (23, 27). Белки семейства Polycomb являются факторами, преимущественно вовлеченными в сайленсинг (подавление экспрессии) генов. Регионы, содержащие гистоны, несущие
В целом описанные эпигенетические изменения в стареющих стволовых клетках согласуются с неоднократно наблюдавшимися функциональными нарушениями: при старении происходит увеличение количества гемопоэтических стволовых клеток с одновременным снижением их способности к дифференцировке (23, 27). Тем не менее, степень, до которой эти изменения являются коррелятивными, а не причинными, до сих пор неясна и заслуживает дальнейшего изучения. В гемопоэтических и мышечных стволовых клетках наблюдаемая в молодом возрасте четкая эпигенетическая регуляция демонстрирует тенденцию к смещению. Это смещение соответствует общему процессу старения: идентичность и общая функциональность стволовых клеток сохраняется, однако ухудшается их способность регенерировать соответствующие ткани.
Внешние факторы влияют на старение стволовых клеток
Влияние локального и системного окружения на функции стволовых клеток во время защищенного старения продемонстрировано путем введения молодых стволовых клеток в старое окружение и наоборот. В таких исследованиях использовались такие стратегии, как гетерохронная трансплантация, при проведении которой полученные от донора одного возраста клетки трансплантируют реципиенту другого возраста, или гетерохронный парабиоз, при котором двух мышей разных возрастов соединяют для создания общей системы кровообращения, что обеспечивает воздействие системного окружения одного животного на клетки другого животного (29) (рисунок 3).
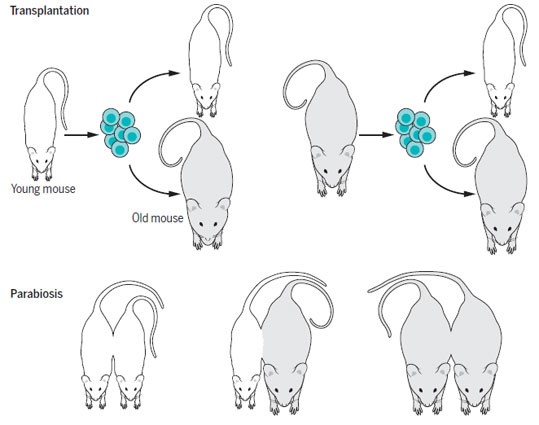
Рисунок 3. Внешние и внутренние факторы оказывают влияние на возрастные изменения функционирования стволовых клеток. В разграничении внутренних и внешних для клетки изменений (например, берущих начало из клеточного окружения) функций клетки помогли гетерохронные исследования. При гетерохронной трансплантации стволовые клетки, полученные от молодых или старых доноров трансплантируют молодым или старым реципиентам, после чего функционирование клетки анализируют в четырех вариантах трансплантации (молодой донор — молодой реципиент, молодой донор — старый реципиент, старый донор — молодой реципиент, старый донор — старый реципиент). При парабиозе организмы животных объединяют для формирования единой общей системы кровообращения. Это обеспечивает воздействие системного окружения организма одного животного на клетки другого животного. В данном случае клеточные функции молодых или старых партнеров в гетерохронных парах (
Когда в условиях гетерохронного парабиоза молодые стволовые клетки подвергались воздействию стареющего системного окружения они начинали испытывать функционального угасание, схожее с происходящим при ускоренном старении (30, 31). С другой стороны, противоположная закономерность также имела место: при погружении в среду молодого организма или под действием молодого системного окружения стареющие клетки приобретали более молодые характеристики, что свидетельствует о возможности ослабления определенных проявлений старения. Эти данные подтолкнули ученых к поиску «стимулирующих старение» факторов в крови старых организмов (смотри ниже) и «стимулирующих молодость» факторов в крови молодых организмов (32–34) [однако также смотри (35)]. Взятые вместе эти исследования демонстрируют, что стволовые клетки подвержены сильному влиянию их окружения, и указывают на то, что содержащиеся в крови факторы могут быть ответственны, по крайней мере, за часть проявлений возрастного угасания функциональности стволовых клеток.
Когда в условиях гетерохронного парабиоза молодые стволовые клетки подвергались воздействию стареющего системного окружения они начинали испытывать функционального угасание, схожее с происходящим при ускоренном старении (30, 31). С другой стороны, противоположная закономерность также имела место: при погружении в среду молодого организма или под действием молодого системного окружения стареющие клетки приобретали более молодые характеристики, что свидетельствует о возможности ослабления определенных проявлений старения. Эти данные подтолкнули ученых к поиску «стимулирующих старение» факторов в крови старых организмов (смотри ниже) и «стимулирующих молодость» факторов в крови молодых организмов (32–34) [однако также смотри (35)]. Взятые вместе эти исследования демонстрируют, что стволовые клетки подвержены сильному влиянию их окружения, и указывают на то, что содержащиеся в крови факторы могут быть ответственны, по крайней мере, за часть проявлений возрастного угасания функциональности стволовых клеток.
Усилия, направленные на идентификацию специфичных ассоциированных с возрастом циркулирующих в крови факторов, неоднократно указывали на провоспалительные молекулы, такие как содержащиеся в крови цитокины, как на сигналы, запускающие процессы старения клеток и тканей (36). Одним из первых «факторов старения», идентифицированных при проведении гетерохронных парабиотических исследований, был цитокин CCL11 (31). Содержание этого белка в крови увеличивается по мере старения, а его введение в кровоток молодых животных приводило к угасанию активности нервных стволовых клеток, подобному происходящему в ходе нормального старения. Аналогичным образом было установлено, что содержание родственного воспалительного цитокина Rantes в нише нервных стволовых клеток по мере старения повышается и способствует возрастному угасанию миелоидной дифференцировки гемопоэтических стволовых клеток (37).
Помимо цитокинов было продемонстрировано, что уровни других ассоциированных с иммунной системой молекул изменяются с возрастом и способствуют развитию фенотипов старения. Было показано, что содержание в плазме компонента системы комплемента C1q увеличивает с возрастом и способствует возрастному угасанию функций мышечных стволовых клеток посредством активация сигнального механизма, опосредуемого белком Wnt (38, 39). Также оказалось, что содержание компонента главного комплекса гистосовместимости
Соматический естественный отбор стволовых клеток
На основании результатов описанных выше исследований можно выделить, по крайней мере, три ключевых фактора, влияющих на соматические стволовые клетки в условиях стареющего организма. С течением времени соматические стволовые клетки приобретают множество мутаций, они претерпевают генетический сдвиг и погружаются в более разнообразную среду, которая может оказать отрицательное влияние на их функции. Каждая из клеток любой популяции стволовых клеток привносит свои уникальные характеристики (например, мутации) и приобретенный опыт (например, локальное воздействие цитокинов) в эволюционирующий адаптивный ландшафт. Можно предположить, что с течение времени взаимодействие этих сил приводит к формированию селективного давления на отдельные стволовые клетки: стволовые клетки, имеющие приобретенные благодаря соматическим мутациям или эпигенетическому сдвигу характеристики, обеспечивающие лучшую адаптацию к стареющему окружению организма, будут преобладать в популяции за счет действия сопровождающего старение организма естественного отбора («соматического естественного отбора»), подобного описанному Дарвином. Эти стволовые клетки обладают характеристиками, обеспечивающими оптимальное выживание в условиях защищенного старения, независимо от других функциональных возможностей. Любые приобретенные ими вредоносные характеристики будут переданы тканям через из потомков в объеме, пропорциональном их относительному содержанию.
Эта точка зрения на клональную динамику имеет как теоретическую, так и экспериментальную подоплеки. Математическое моделирование популяций стволовых клеток прогнозирует, что постоянная конкуренция в замкнутом окружении приведет к доминированию одной стволовой клетки даже в отсутствие
Изучение тонкого кишечника грызунов привело к появлению следующих идей. Дифференцированные клетки кишечных ворсинок постоянно обновляются за счет стволовых клеток, локализующихся в специализированных углублениях (криптах) у основания ворсинок. Каждая крипта содержит несколько стволовых клеток, которые конкурируют за возможность заселения соответствующей ворсинки. Даже в отсутствие отбора отдельные стволовые клетки начинают совершенно случайным образом доминировать в криптах, что соответствует прогнозам теории нейтрального сдвига (рисунок 4) (44, 45). Даже незначительно повышающие пролиферацию мутации, такие как мутации онкогена
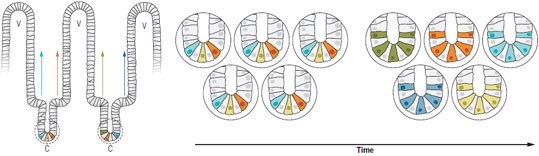
Рисунок 4. Нейтральный сдвиг популяций стволовых клеток. Слева: внутренняя поверхность тонкого кишечника имеет ворсинки (v), состоящие из дифференцированных клеток, популяция которых обновляется (стрелки) потомками стволовых клеток, локализованных в криптах ©. Справа: при близком рассмотрении крипт (фрагменты, мысленно вырезанные по пунктирной линии) видны домены разных стволовых клеток (каждый из которых представлен отдельным цветом). С возрастом стволовые клетки крипт постоянно конкурируют друг с другом, в результате чего с течение времени в каждой отдельной крипте все стволовые клетки являются потомками одной стволовой клетки. Эти предположения основаны на данных, полученных в экспериментах на мышах (44). Определенные генетические изменения и условия окружающей среды могут ускорять этот процесс.
Несмотря на отсутствие экспериментальных доказательств, можно предположить, что аналогичные силы ведут к проявлению клонального доминирования, как характеристики старения системы гемопоэза (рисунок 2). Согласно этой гипотезе, только немногие из приобретенных гемопоэтическими стволовыми клетками мутаций наделют их преимуществами в условиях молодого организма, что позволяет гемопоэзу сохранять высокую поликлональность. Напротив, эти же мутации, скомбинированные с помощью эпигенетического сдвига, могут обеспечить значительное преимущество с точки зрения выживания и/или пролиферации в изменяющемся возрастном окружении, открывая возможность экспансии определенных гемопоэтических стволовых клеток и клонального доминирования. И действительно, у молодых мышей гемопоэтические стволовые клетки с нокаутированным Tp53 не имеют особенных преимуществ, однако в стареющих организмах они начинают доминировать по сравнению с нормальными клетками (16). Авторы предполагают, что мутации генов DNMT3A и TET2 могут аналогичным образом обеспечивать преимущество в стареющем окружении. Эту точку зрения поддерживает наблюдение, согласно которому некоторые мутации, ассоциированные с клональным гемопоэзом (например, мутации факторов сплайсинга), начинают превалировать только после достижения
При более широком рассмотрении высокодинамичные ткани, такие как кишечник и костный мозг, содержат стволовые клетки, непрерывно конкурирующие друг с другом. Поэтому любое внутриклеточное изменение, как генетической, так и другой природы, обеспечивающее преимущество в росте или выживании, может приводить к доминированию определенных стволовых клеток (рисунок 5).
Это важно, так как селективное окружение (адаптивный ландшафт) изменяется с возрастом. В стареющих организмах такие факторы, как системное воспаление, могут предоставлять преимущества стволовым клеткам, обладающим определенными характеристиками. Стволовые клетки, лучше реагирующие в условиях старения или повреждения, могут быть не самыми эффективными при необходимости регенерации здоровой ткани если их потомки также являются носителями соматических мутаций или подвержены эпигенетическому сдвигу. Эти общие принципы с большой вероятностью действуют во многих тканях, хотя их проявления отличаются в зависимости от таких факторов, как скорость обновления ткани, локальные взаимодействия между стволовыми клетками, физические ограничения смены клеток и выраженность изменений адаптивного ландшафта. Например, в таких тканях, как скелетная мускулатура, для которых, согласно современным представлениям, характерна низкая скорость смены стволовых клеток и обновления ткани, внутренняя конкуренция и силы отбора могут иметь меньшую важность. Даже в кишечнике конкуренция стволовых клеток проявляется исключительно внутри крипт, а не между отдельными криптами. Таким образом, расширение понимания роли, принадлежащей конкуренции соматических стволовых клеток в различных тканях может быть исключительно важным в будущем.
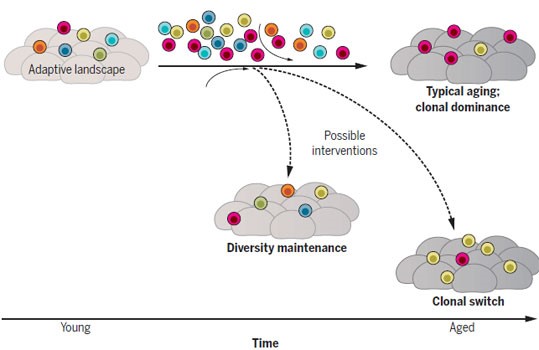
Рисунок 5. Модель возрастного отбора стволовых клеток с новыми характеристиками и его потенциальные исходы. У молодых индивидуумов поликлональная популяция гемопоэтических стволовых клеток дает начало генерогенной популяции клеток крови. С возрастом стволовые клетки приобретают соматические мутации и переносят эпигенетический сдвиг. Одновременно происходит угасание («коллапс») некоторых клонов и постепенный сдвиг адаптивного ландшафта. Это может отчасти вызываться изменениями уровней гуморальных факторов (таких как циркулирующие цитокины или факторы воспаления) или изменениями клеточного окружения, регулирующего функционирование стволовых клеток, так называемой ниши (изменения могут происходить как в составе, так и в поведении ниши). Результатом изменения ландшафта и уменьшения поликлональности может быть популяционное «бутылочное горлышко», что предоставляет возможность для экспансии клонов, обладающих селективным преимуществом. В конечном итоге это приводит к
И наконец, как внешняя среда и соматические мутации взаимодействуют в комплексе с эпигенетическим модулированием? Эпигенетический сдвиг возникает даже в отсутствие определенных соматических мутаций, движимый адаптацией к изменяющемуся окружению и обеспечивающий ее. Частая селекция мутаций в генах эпигенетических регуляторов (например, DNMT3A и TET2) может указывать на то, что это обеспечивает определенную степень эпигенетической пластичности, облегчающей адаптацию к характерному для старения окружению.
Заключение
Взятые вместе исследования, посвященные изучению соматических мутаций, эпигенетического сдвига и влияния окружающей среды на стволовые клетки, открывают новый взгляд на старение и перспективы сохранения здоровых функций тканей по мере старения. После прекращения роста организма стволовые клетки эффективно обновляют ткани на протяжении лет, соответствующих пику репродуктивной способности. По окончании этого периода не остается эффективных механизмов, отобранных эволюцией для предотвращения постепенного угасания здоровья клеток и тканей. Вместо этого разнообразные генетические, эпигенетические и внешние факторы вызывают сдвиг до тех пор, пока внутренняя среда стареющего организма не начинает оказывает действие, достаточно сильное для того, чтобы вызвать отбор определенных (обычно губительных) характеристик (рисунок 5). Накапливающиеся с возрастом мутантные стволовые клетки сами по себе не вызывают старение, они просто используют стареющее окружение для приобретения доминирующего положения. Функциональные нарушения, которые они передают своим потомкам, в свою очередь, способствуют формированию ассоциированных со старением фенотипов.
С данными взглядами, как стратегии или вмешательства можно представить себе для увеличения продолжительности здоровой жизни путем воздействия на стволовые клетки? Из описанных выше исследований естественным образом вытекают для подхода.
Возможно ли уменьшить количество соматических мутаций? Большинство из них вероятно являются неизбежным последствием клеточного деления и реакций дезаминирования, приводящих к переходу C→T (цитозин→тимин) (51, 52).
После признания невозможности устранения всех мутаций, следующим подходом является изменение адаптивного ландшафта таким образом, чтобы он способствовал отбору более функциональных клеток. К моменту вступления в фазу защищенного старения стволовые клетки уже приобретают достаточно большое количество соматических мутаций (в значительной степени неизбежное последствие клеточного деления) и переносят эпигенетический сдвиг. Авторы предполагают, что мониторинг изменений и раннее модулирование внутренней среды организма, такое как снижение уровней медиаторов воспаления и осуществляемое другими способами замедление возрастной трансформации системной внутренней среды организма, может ограничить формирование клонального доминирования, обеспечивая продление периода поликлонального состояния (рисунок 5). В качестве альтернативы, обеспечение нового адаптивного ландшафта, к которому лучше адаптированы другие варианты стволовых клеток, может аналогичным образом способствовать поддержанию здоровья тканей. По этому же принципу, интересно, что проведенные на ранних этапах жизни генетические манипуляции, сохраняющие пролиферативный гомеостаз стволовых клеток кишечника
Использованная литература:
1.
2. L. Liu,
3.
4. M. Xie et al., Nat. Med. 20, 1472–1478 (2014).
5. S. Jaiswal et al., N. Engl. J. Med. 371, 2488–2498 (2014).
6. G. Genovese et al., N. Engl. J. Med. 371, 2477–2487 (2014).
7. T. McKerrell et al., Cell Rep. 10, 1239–1245 (2015).
8.
9. T. McKerrell,
10.
11. C. Quivoron et al., Cancer Cell 20, 25–38 (2011).
12. K.
13. M. Ko et al., Proc. Natl. Acad. Sci. U.S.A. 108, 14566–14571 (2011).
14. C. Kandoth et al., Nature 502, 333–339 (2013).
15. Y. Liu et al., Cell Stem Cell 4, 37–48 (2009).
16. M. Dumble et al., Blood 109, 1736–1742 (2007).
17. A. Bonnefond et al., Nat. Genet. 45, 1040–1043 (2013).
18. I. Martincorena et al., Science 348, 880–886 (2015).
19. C. Tomasetti, B. Vogelstein, Science 347, 78–81 (2015).
20.
21. K. Chen et al., Nat. Genet. 47, 1149–1157 (2015).
22. P. Sen et al., Genes Dev. 29, 1362–1376 (2015).
23. D. Sun et al., Cell Stem Cell 14, 673–688 (2014).
24. L. Liu et al., Cell Rep. 4, 189–204 (2013).
25. J. Feser et al., Mol. Cell 39, 724–735 (2010).
26. W. Zhang et al., Science 348, 1160–1163 (2015).
27. I. Beerman et al., Cell Stem Cell 12, 413–425 (2013).
28. S. Maegawa et al., Genome Res. 20, 332–340 (2010).
29.
30.
31.
32.
33. C. Elabd et al., Nat. Commun. 5, 4082 (2014).
34. M. Sinha et al., Science 344, 649–652 (2014).
35.
36. C. Franceschi et al., Mech. Ageing Dev. 128, 92–105 (2007).
37. A.
38.
39.
40.
41.
42. S. Wright, Am. Nat. 63, 556–561 (1929).
43. S. Wright, Proc. Sixth Int. Congr. Genet. 1, 356–366 (1932).
44.
45. C.
46.
47. L. Vermeulen et al., Science 342, 995–998 (2013).
48.
49.
50.
51.
52. S. Behjati et al., Nature 513, 422–425 (2014).
53. B. Biteau et al., PLOS Genet. 6, e1001159 (2010).
ОБЗОР
Margaret A. Goodell and Thomas A. Rando
Stem cells and healthy aging
Science 4 December 2015: Vol. 350 no. 6265 pp. 1199–1204 DOI: 10.1126/science.aab3388
http://www.sciencemag.org/content/350/6265/1199.abstract


