Исследователи из Медицинской школы Перельмана Университета Пенсильвании продемонстрировал новый способ иммунотерапии с помощью препарата на основе мРНК, который репрограммирует Т-клетки пациента для атаки на гиперактивные фибробласты сердца.
Сердечная недостаточность, как правило, частично связана с нарушением функционирования фибробластов, которые отвечают на повреждение сердца и воспаление хроническим избыточным синтезом компонентов межклеточного матрикса, что приводит к фиброзу и ослаблению миокарда. В экспериментах на мышиных моделях сердечной недостаточности уменьшение количества фибробластов за счет репрограммированных Т-лимфоцитов привело к восстановлению тканей.
Новая методика основана на технологии CAR Т-терапии. В классическом варианте она требует забора Т-клеток пациента и их генетического репрограммирования для распознавания маркеров на конкретных типах клеток в организме. Эти измененные Т-клетки затем вводятся пациенту для атаки на определенный тип клеток. Метод CAR T-терапии был создан исследователями Университета Пенсильвании и Детской больницы Филадельфии. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США в 2017 году одобрило его для лечения лейкозов и лимфомы – опухолей, которые возникают из В-лимфоцитов.
Авторы предположили, что технологию CAR T-терапии можно использовать для лечения других заболеваний, включая фиброз сердца и сердечную недостаточность. Для этого нужно было модифицировать ее, так как в здоровом организме фибробласты необходимы, особенно для заживления ран, а CAR Т-клетки, нацеленные на фибробласты, могут сохраняться в организме в течение месяцев или даже лет, подавляя их популяцию в течение всего этого времени.
В новом исследовании группа разработала методику для временного и управляемого, а с методологической точки зрения гораздо более простого типа Т-клеточной терапии. Для этого была использована матричная РНК (мРНК), которая кодирует химерный антигенный рецептор (CAR), нацеленный на гиперактивные фибробласты. Эта мРНК была помещена в липидные наночастицы, которые сами покрыты молекулами, содержащимися в Т-клетках. Эта технология уже используется в вакцинах от COVID-19 на основе мРНК.
Введенные мышам инкапсулированные мРНК поглощаются Т-лимфоцитами и действуют в ядре как шаблон для производства белка-рецептора, нацеленного на фибробласты. Таким образом иммунные клетки репрограммируются для атаки на фибробласты, но эффект носит временный характер, так как мРНК не интегрируются в ДНК и выживают в Т-лимфоцитах всего несколько дней, после чего клетки возвращаются в нормальное состояние и больше не атакуют фибробласты.
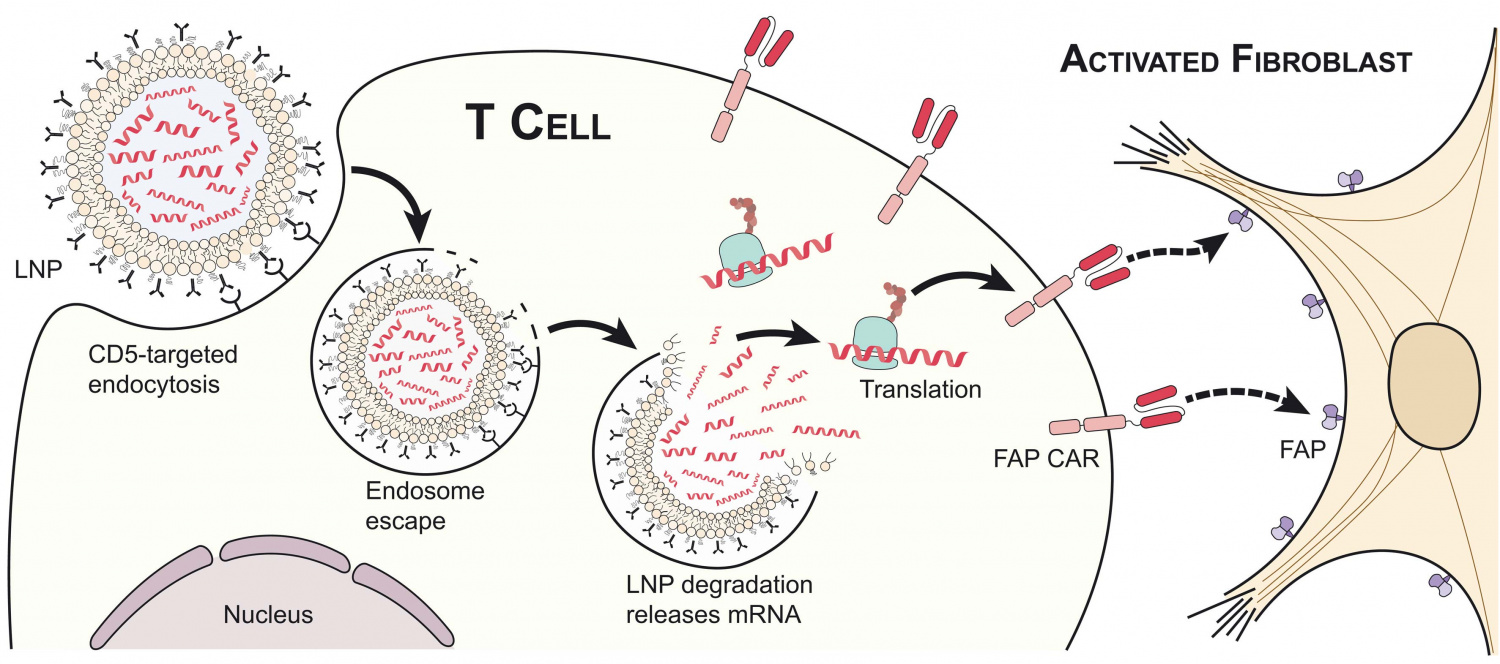
Исследователи обнаружили, что, несмотря на эту непродолжительную активность, однократная инъекция мРНК мышиным моделям сердечной недостаточности привела к репрограммированию большей части популяции Т-лимфоцитов, что привело к значительному уменьшению фиброза сердца у животных и восстановлению нормального размера и функции сердца без признаков продолжающейся активности Т-клеток против фибробластов через неделю после лечения.
Исследователи продолжат тестировать мРНК-технологию CAR Т-терапии в надежде в скором времени перейти к клиническим исследованиям.
Статья J.G.Rurik et al. CAR T cells produced in vivo to treat cardiac injury опубликована в журнале Science.
Аминат Аджиева, портал «Вечная молодость» vechnayamolodost.ru по материалам University of Pennsylvania: Vaccine-like mRNA injection can be used to make CAR T cells in the body.


