Как и зачем создают индивидуальные лекарства
Ситуация, при которой пациенту назначают одно лекарство за другим и методом проб и ошибок выясняют, какое сработает, в научной литературе называется реактивной моделью медицины: человек каким-то образом реагирует на препарат, а врачи – уже на реакцию пациента. Клинический фармаколог Дмитрий Сычев рассказал ПостНауке, почему важно постепенно переходить к иному способу взаимодействия с пациентом, как закладывались основы персонализированной медицины и на анализе каких показателей – биомаркеров – она основана.
Как конские бобы привели к новой медицине и для чего нужна ПЦР?
По легенде еще древнегреческий философ Пифагор заметил, что люди по-разному реагировали на конские бобы, которые в античном мире часто употребляли в пищу. Он обратил внимание, что реакция в виде малокровия носила наследственный характер: если в семье был человек, плохо усваивающий конские бобы, то у его родственников тоже возникала непереносимость. В начале XX века ученые выяснили, что такая реакция связана с врожденным (генетическим) дефицитом определенного фермента – глюкозо-6-фосфатдегидрогеназы (Г6ФД), которая и приводит к развитию гемолитической анемии, то есть малокровию, связанному с повышенным разрушением эритроцитов.
Эта гипотеза подтвердилась в 1940-е годы, когда во время военных кампаний европейских государств и США в южные страны солдатам давали профилактические противомалярийные препараты, например «Примахин». У представителей определенных рас и их родственников развивалась гемолитическая анемия, связанная с дефицитом Г6ФД. Этот наследственный дефицит по-разному распространен среди этносов, но есть закономерность: его частота увеличивается с севера на юг. В СССР, где эту проблему активно изучали, больше всего людей с врожденным дефицитом Г6ФД обнаружили в республиках Закавказья, особенно в Азербайджане. Сегодня существует список препаратов, которые не рекомендуется давать людям с таким генетическим дефицитом и которые вызывают гемолитическую анемию.
В 1952 году стали широко применять препарат изониазид, который совершил революцию в лечении туберкулеза и позволил избежать хирургического вмешательства (раньше с этим заболеванием справлялись только путем удаления части или целого легкого). Однако врачи заметили, что на людей изониазид действовал с разной эффективностью, различалась и его концентрация в моче у пациентов. Оказалось, что это связано с неодинаковой скоростью ацетилирования, то есть химического превращения изониазида, а в зависимости от этнической принадлежности всех людей можно разделить на медленных и быстрых ацетиляторов изониазида. Кстати, частота быстрого ацетилирования тоже нарастает с севера на юг, а в европейских этнических группах быстрых и медленных ацетиляторов примерно поровну. При этом медленные ацетиляторы изониазида, как правило, блондины со светлой кожей и голубыми глазами, то есть фармакогенетические признаки могут быть сцеплены с фенотипическими признаками. Сейчас врачи стараются варьировать дозирование изониазида в зависимости от генетических особенностей каждого пациента.
Постепенно особенности действия препаратов на разных людей стали связывать с генетическими факторами. В результате активного исследования генов, регулирующих действие некоторых лекарств, зародилась фармакогенетика, которая в 1950-е годы выделилась в отдельную дисциплину.
Уже в 1960–1970-е годы ученые стали применять близнецовый метод, чтобы понять, существуют ли наследственные (генетические) факторы, которые могут влиять на действие того или иного лекарственного препарата. Для этого сопоставляли, какие химические и биологические процессы происходили с препаратом в организме близнецов, и по «близости» параметров этих процессов делали вывод о влиянии наследственности.
В СССР проблемой выявления фармакогенетических феноменов с 1980-х годов активно занимался академик Владимир Кукес и его ученики. Им удалось определить специальные ферменты в печени, которые участвуют в переработке активных компонентов лекарств. Наличие этих ферментов влияло на выбор подходящего для человека лекарства и его дозирование.
В 1983 году американский биохимик Кэри Муллис изобрел полимеразную цепную реакцию (ПЦР), которую в 1990-е годы начали использовать для выявления генетических особенностей человека, а значит, теперь можно было прогнозировать ответ на лекарственную терапию. В фармакогенетических целях ПЦР одним из первых применил профессор Евгений Шварц, который изучал мутации генов, связанные с чувствительностью к антикоагулянтам – препаратам, разжижающим кровь, в частности к варфарину.
Как работает ПЦР?
Метод ПЦР основан на многократном избирательном копировании нужного участка ДНК. Для проведения ПЦР у пациентов берут образец крови и с помощью ферментов in vitro («в пробирке») проводят амплификацию, то есть многократно удваивают определенный участок ДНК, делая его визуально доступным. Затем исследуют этот участок гена, чтобы понять, является ли человек носителем мутаций, ответственных за те или иные реакции на препарат.
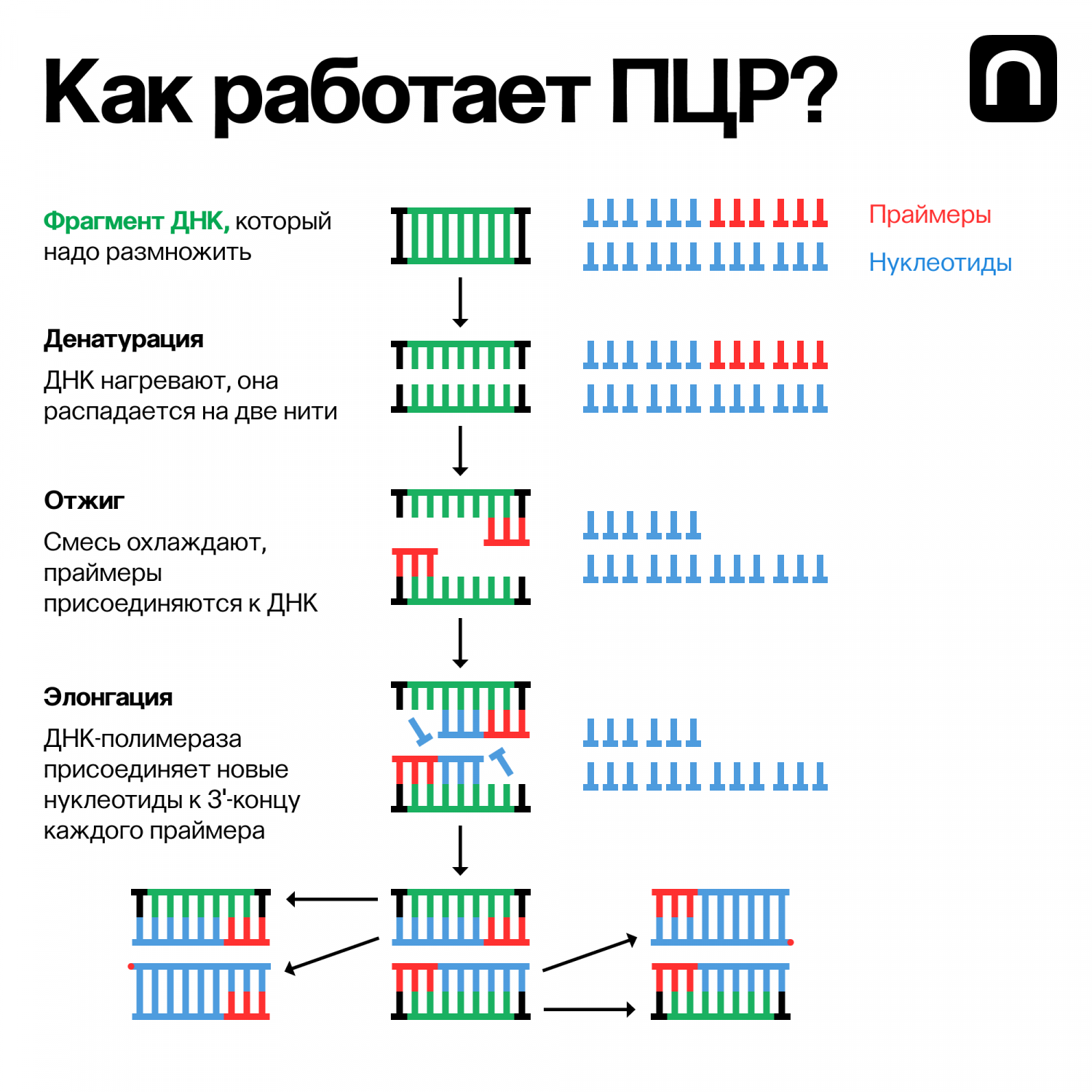
Рисунки Кати Золотарёвой
В качестве альтернативы ПЦР в России использовали методы фенотипирования: определяли концентрацию лекарств в моче и крови и по ним определяли скорость переработки препарата, по которой можно было судить о том, насколько хорошо он усваивается. Сегодня эти методы называют терапевтическим лекарственным мониторингом и применяют в основном в научных исследованиях.
Что не так с традиционными лекарствами?
Традиционные лекарства создаются для лечения какого-либо заболевания, однако от 38 до 75% новых препаратов оказываются неэффективными и имеют какие-либо последствия для пациента. Перед внедрением в клиническую практику любое лекарство должно пройти сложный путь доклинических испытаний на тканях и подопытных животных, а также клинических исследований, результаты которых в итоге усредняются. На самом деле во время испытаний препарата всегда будут пациенты, которые хорошо на него реагируют, а для других это лекарство окажется неэффективным или вызовет у них нежелательные реакции.
При подобном исследовании есть статистический показатель – NNT (number needed to treat), показывающий, сколько в среднем пациентов нужно «пролечить» новым препаратом по сравнению со старым, чтобы избежать одного инфаркта, инсульта или смерти. Например, если для какого-то препарата NNT будет равен 50, это значит, что 50 пациентов нужно перевести со старого препарата на новый, чтобы избежать одной смерти, но чьей именно – неясно. Суть медицинской персонализации заключается в том, чтобы выделить именно тех пациентов, которым этот препарат действительно будет помогать и у которых не будет вызывать побочных эффектов.
Фармакологический ответ разных пациентов на одни и те же лекарства зависит от генетических и негенетических факторов. К последним относятся, например, пол и возраст. Побочные реакции, особенно аллергические, чаще встречаются у женщин, чем у мужчин, а с возрастом у многих людей нарушаются функции печени и почек, препараты хуже выводятся из организма и чаще вызывают нежелательные эффекты. Лекарства могут действовать по-разному в зависимости от того, курит ли человек, употребляет ли он алкоголь, какой диеты придерживается и какие еще препараты принимает.
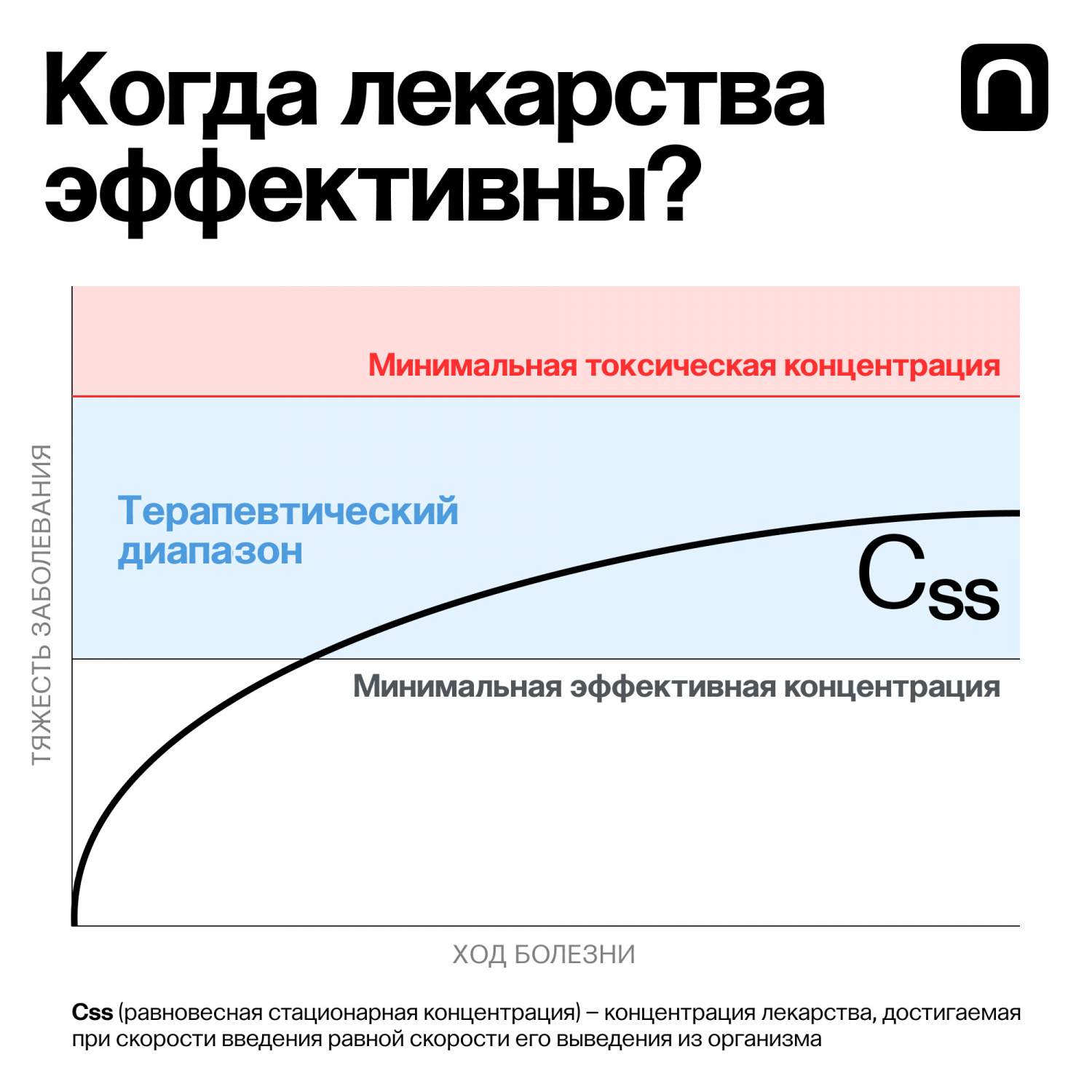
Подход к ведению пациента, основанный на учете набора индивидуальных характеристик, лег в концепцию персонализированной медицины, то есть профилактики, диагностики и лечения на основе показателей, которые можно измерить и которые отображают индивидуальные особенности самого человека или патологического процесса. Такие показатели принято называть биомаркерами. Они могут быть клиническими (например, частота сердечных сокращений, пульс), биохимическими (показатель свертывания крови, маркеры белкового, углеводного и липидного обмена, показатели функций различных органов) и генетическими (ДНК-маркеры). Одни биомаркеры прогнозируют эффективность ответа на лекарственные препараты, другие, наоборот, предсказывают неэффективность лечения, резистентность к каким-то препаратам или методикам либо развитие побочных реакций и осложнений.

Что могут сказать гены о реакции на лекарства и зачем нужен генетический паспорт?
Генетические факторы ответа на лекарства – особенности, доставшиеся нам от родителей, бабушек и дедушек, так же как и непереносимость конских бобов. Современные генетические тесты, а именно фармакогенетические, позволяют выявить конкретные генотипы пациентов, связанные с фармакологическим ответом на тот или иной препарат. В качестве генетического материала подойдет кровь, буккальный эпителий (внутренней стороны щеки), волосы, слюна.
Генетические маркеры могут определять ответ даже на некоторые вакцины. Исследованию этого феномена посвящено отдельное перспективное направление – вакциномика. Доказано, например, что есть генетические маркеры, определяющие лучший иммунный ответ на прививку против бешенства. Сегодня на основе генетических исследований также разрабатываются диетические рекомендации и советы относительно физических упражнений. Этим занимается нутригеномика – наука, изучающая влияние питания на экспрессию генов. Также сегодня существует много спекулятивных коммерческих историй. Например, в Европе есть компания, которая по анализу вашего генотипа подберет наиболее подходящее для вас красное вино и даже пришлет вам бутылочку. Это направление называется виномика.
Фармакогенетическое тестирование сегодня в подавляющем большинстве случаев проводится с помощью ПЦР и доступно практически всем. Молекулярно-генетические тесты, предсказывающие чувствительность к тому или иному препарату, делаются один раз на всю жизнь. Накапливая эти данные, можно сформировать персонализированную фармакогенетическую карту эффективности лекарств, которая в будущем станет генетическим паспортом.
Кроме ПЦР сегодня существует ряд новых методов молекулярного анализа. В основе современной персонализированный медицины, прежде всего фармакогеномики, изучающей в генетическом материале полную последовательность ДНК, лежит использование геномики, транскриптомики, протеомики, метаболомики и микробиомики. Эти технологии называются омиксными, так как в английском языке их названия оканчиваются на -omics (genomics, transcriptomics и так далее). Другое их название – постгеномные технологии.
Транскриптомные технологии направлены на изучение работы определенных генов, на основании которых можно судить о воздействии на организм того или иного препарата. Протеомика занимается белковым уровнем: идентификацией новых белков, анализом их содержания в плазме, моче и так далее. С помощью метаболомики дают прогноз ответа на лекарственное средство, исходя из анализа совокупности метаболитов, то есть промежуточных и конечных продуктов обмена веществ различных соединений: углеводов, белков, липидов, нуклеиновых кислот, а также малых органических молекул – в моче, крови и так далее. Микробиомика разрабатывает подходы к персонализации в зависимости от микробиоты кишечника, слизистых оболочек или кожи.
По сравнению с использующейся в фармакогенетическом тестировании ПЦР в фармакогеномике применяются более дорогие методы секвенирования нового поколения (next generation sequencing, NGS), хроматографические методы, масс-спектрометрическая детекция. Пока что эти технологии используют только в исследовательских целях, но, возможно, в будущем они найдут практическое применение и будут взаимодополнять друг друга, повышая точность предсказания ответа на лекарственную терапию и тем самым приближая нас к прецизионной модели медицины.
Если в 2018 году в российском Минздраве говорили о концепции медицины «трех П» – профилактической, персонализированной и предиктивной, – то сегодня речь идет уже о медицине многих «П»: считается, что она должна быть персонализированной, предиктивной, превентивной, партисипативной и так далее, а главное – прецизионной, то есть медициной, в рамках которой биомаркер является точным диагностическим критерием, предсказывающим выбор соответствующего лечения.
Как создают индивидуальные препараты
Основные цели, которые преследуют ученые при создании персонализированных препаратов, – повышение эффективности лекарственных средств и снижение количества побочных реакций. Препараты создаются сразу вместе с биомаркерами, которые будут указывать на достижение обеих целей. Связка «препарат – биомаркер» должна быть проверена в больших, хорошо спланированных исследованиях.
Кроме того, фармакогенетические биомаркеры разрабатываются не только для персонализации новых лекарств, но и для формирования аналогичного подхода в отношении уже известных препаратов. Именно благодаря концепции персонализации «реабилитировали» многие старые лекарства. Поиск адекватных биомаркеров показал, что не всем подряд нужно назначать препараты нового поколения, потому что есть люди, которые хорошо реагируют и на старые лекарства без нежелательных побочных реакций.
Теоретически персонализировать можно любой препарат. Но на практике перед тем, как принять обезболивающее, если у вас, например, болит голова, не всегда нужно идти в генетическую лабораторию. Большинство экспертов считают, что подобного рода тестирование необходимо только для высокоэффективных, но проблемных препаратов с большим спектром побочных действий. Также фармакогенетические тесты могут повысить безопасность лечения у пациентов с высокими рисками неблагоприятных реакций: пожилых людей, пациентов с сопутствующими заболеваниями, полиморбидностью (то есть синхронно протекающими заболеваниями) печени и почек, людей, принимающих сразу много лекарств.
Вероятно, в будущем будут создаваться индивидуальные препараты для каждого человека. Такие примеры уже есть, например терапия редких генетических заболеваний. Однако, скорее всего, эта персонализация будет основана на больших исследованиях, в которых будут учитываются самые разные генетические и негенетические факторы. На их основе будет выстраиваться модель, прогнозирующая лекарственный ответ. Специальные программы – системы поддержки принятия решений – будут прогнозировать для каждого пациента, какие препараты будут лучше работать в его конкретном случае. В основу этих программ лягут большие данные – накапливающиеся биобанки ДНК, содержащие всю информацию о человеке: чем болеет, какие препараты у него вызывают побочные реакции и так далее. Такие регистры существуют уже сейчас и создаются по определенной методологии – соответственно, информация в них пополняется и анализируется с помощью машинного обучения. Разумеется, люди дают согласие на использование их генетического материала для подобного рода исследований.
С позиций фармакоэкономики, подразумевающей оценку экономической целесообразности того или иного метода лечения, фармакогенетика очень выгодна, потому что может сказать, кому поможет дешевое старое лекарство, а кому нужны более дорогие современные препараты. Существует целая система клинико-экономической оценки технологий здравоохранения, завязанная на фармакоэкономике и изучающая, как препарат или тест движется от разработки к клинической практике. Есть также модели, учитывающие региональные особенности этнического состава населения и распространенности определенных мутаций генов.
Трудности внедрения персонализированной медицины, онкологические заболевания и COVID-19
К сожалению, технологии персонализации, особенно старых препаратов, и их изучение в хорошо спланированных исследованиях не очень хорошо финансируются. Дело в том, что фармкомпании изготавливают лекарственные препараты и делают так, чтобы как можно большему числу людей назначали именно их. Вкладываться в персонализацию невыгодно, потому что такой подход предполагает, что лекарства выписывают только узкому кругу пациентов. Поэтому исследования в области персонализированной медицины преимущественно спонсируются различными фондами, в том числе государственными. Из-за недостатка финансирования эти исследования не обладают необходимым масштабом. Но можно усилить доказательность персонализированных методов с помощью систематических обзоров и метаанализа, и тогда генетическое тестирование включат в клинические рекомендации, а значит, в будущем и в стандарты лечения.
Невысокие темпы внедрения персонализированной медицины связаны не только с экономическими факторами. Есть проблема доступности фармакогенетических тестов и недостаточной осведомленности врачей и организаторов здравоохранения о необходимости такого тестирования. Поэтому важно, чтобы в образовательных организациях и профессиональных сообществах формировались соответствующие компетенции, которые позволят медикам понимать, когда необходимо использовать персонализированные тесты и препараты и как правильно их применять. Доказано, что если во время обучения врачей, помимо традиционных форматов (лекций, семинаров и так далее), использовать активное обучение, то они чаще будут применять фармакогенетические тесты в своей практике. Для этого можно проводить самим же студентам – разумеется, с их согласия – молекулярно-генетическое тестирование и разбирать подходы к персонализации на примере их собственных результатов.
Персонализированный подход на практике сейчас применяется прежде всего при лечении онкологических заболеваний, особенно ассоциированных с плохим прогнозом и быстрым течением. Появление таргетных препаратов – это не что иное, как персонализация лекарственных средств, направленных на ключевую мишень в канцерогенезе, то есть процессе образования опухоли. Все чаще персонализированный подход применяется в кардиологии для профилактики первичных и вторичных сердечно-сосудистых осложнений, особенно тромботических. Персонализации требует и назначение психотропных препаратов.
В пандемию COVID-19 тоже уже возникла необходимость в персонализированном подходе к лечению. В самом начале пандемии терапия коронавирусной инфекции была основана прежде всего на эмпирическом, патогенетическом, симптоматическом подходе и буквально намеках на доказательства того, что тот или иной препарат может помочь. Во всех странах постепенно появляются новые рекомендации, подходы к лекарственной терапии меняются в зависимости от тяжести заболевания и особенностей течения – это тоже биомаркеры, на которые можно ориентироваться.
Патогенез – механизм зарождения и развития заболеваний и отдельных их проявлений. Он рассматривается на различных уровнях – от молекулярных нарушений до нарушений в работе организма в целом. Изучая патогенез, медики выявляют, каким образом развивается заболевание.
Скорее всего, универсального препарата от коронавирусной инфекции не будет. Многие врачи замечают, что некоторые лекарства работают лишь для определенной категории пациентов. Как показывают последние исследования, действительно есть мутации генов, ассоциированные с более тяжелым течением заболевания и плохим ответом на лекарственную терапию. Поэтому сегодня идет поиск молекулярно-генетических биомаркеров и в области лечения COVID-19. Кстати, для терапии антикоагулянтами такие биомаркеры уже существуют, например D-димер.
Переход от реактивной модели медицины, когда врачи назначают лекарства методом «проб и ошибок», к прецизионной, то есть точной модели, позволяет сократить время подбора и сразу назначить препарат, который с наибольшей вероятностью будет работать эффективно и безопасно. Впрочем, современные технологии персонализированной медицины не отменяют учета клинических данных пациента. Просто сегодня к истории болезни, полу, возрасту, массе тела и жалобам пациента теперь можно добавить целый набор других инструментов – биомаркеров.
Кроме того, фармакогенетика и персонализированная медицина ни в коем случае не должны противопоставляться доказательной медицине, основанной на рандомизированных исследованиях. Фармакогенетические тесты так же испытываются, проходят все «жернова» доказательной медицины и лишь после этого встраиваются в систему клинических рекомендаций и стандарты лечения.
Об авторе: Дмитрий Сычев – доктор медицинских наук, профессор, профессор РАН, член-корреспондент РАН, заведующий кафедрой клинической фармакологии и терапии, ректор РМАНПО Минздрава России.
Дмитрий Сычев, ПостНаука
Портал «Вечная молодость» vechnayamolodost.ru


