Новый терапевтический метод, зарегистрированный под названием Холоклар (Holoclar), предназначен для лечения слепоты, возникшей
Значимое событие произошло в феврале в области лечения стволовыми клетками. Раньше в массовой терапии использовались только стволовые клетки крови. Теперь впервые регулирующий орган европейской страны одобрил коммерческое применение другого типа стволовых клеток для лечения больных людей.
Стволовые клетки крови использовались уже давно: пересадка костного мозга, проводимая людям с пролиферативными заболеваниями (раком) крови или людям, — это и есть замещение собственных стволовых клеток крови пациента на донорские клетки. Прогресс этого метода связан, в основном, с двумя вещами: более тщательным подбором доноров и разработкой методик выращивания большого количества стволовых клеток из небольшого. В частности, у донора сейчас берут уже не костный мозг, а кровь из вены, в крови находят стволовые клетки и их размножают.
Клетки крови недолго живут и часто обновляются. Поэтому у стволовых клеток крови пролиферативный потенциал (то есть способность делиться) выше, чем у других клеток, и для них задача интенсивного размножения в культуре была решена раньше всех.
Новый терапевтический метод зарегистрирован под названием Холоклар (Holoclar). Интервью с его автором, итальянкой Грациеллой Пеллегрини опубликовал журнал Nature (Alison Abbott, Behind the scenes of the world’s first commercial
На внешней поверхности глаза находится роговица. Она прозрачна, снаружи выпукла, а если смотреть изнутри глаза — вогнута. Роговица играет роль собирающей линзы, на нее приходится примерно две трети всей оптической силы глаза. Роговица частично состоит из живых клеток, а частично из высокомолекулярных белков матрикса: коллагена, ламинина
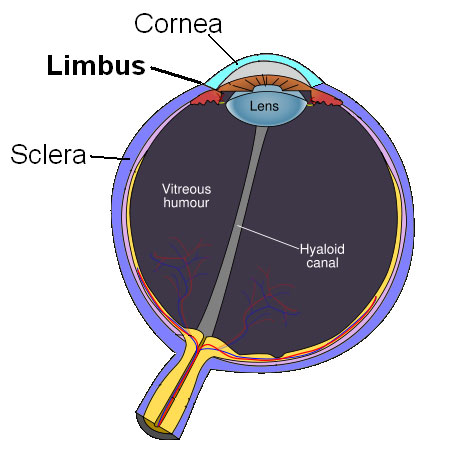
Когда лимб поврежден, например,
Иногда оказывается так, что не все стволовые клетки погибли, но оставшихся слишком мало, чтобы справиться с задачей. Именно таким клеткам могут помочь врачи. Для успеха авторам методики хватает неповрежденного фрагмента лимба размером 1 на 2 мм (диаметр роговицы равен примерно 10 мм, значит, длина границы, на которой находится лимб, составляет примерно 30 мм, ширина лимба — 1–1,5 мм, то есть достаточно всего нескольких процентов).
Оставшийся неповрежденным фрагмент культивируется на подложке из модифицированного фибрина — полимера, участвующего в свертывании крови и формировании тромба. Фибрин обладает двумя нужным свойствами: он жесткий, то есть, выращенные клетки можно будет на такой подложке перенести в глаз и трансплантировать, и он сам деградирует через некоторое время после трансплантации; для деградации фибрина у организма есть специальные методы, поскольку часто приходится растворять отслужившие свое тромбы.
Подбор среды для выращивания клеток позволяет им размножаться гораздо быстрее, чем они размножались бы в естественных условиях при постоянном воспалительном процессе. Готовым к трансплантации авторы методики считали фрагмент, содержащий 3000 стволовых клеток.
Авторы разработки говорят, что только в Европе каждый год в результате несчастных случаев у них появляется около тысячи новых пациентов: людей, пострадавших от ожогов, но сохранивших часть лимба неповрежденной.
Судьба изобретения складывалась очень непросто. Его авторы — итальянцы, и работали они в Италии. В Италии биомедицинские научные разработки поддерживают мало, и ученым приходилось непросто. Грациелла Пеллегрини и Мишель де Лука начали работать над этой темой еще в 1990 году в Женеве. В 1996 году они перебрались в католический госпиталь в Риме, но там были не слишком заинтересованы в превращении фундаментальных разработок в лекарство для людей, и авторы отправились в Венецию. В 1997 году исследователи опубликовали первые результаты: они применили технологию к первым двум полностью ослепшим пациентам, и к ним вернулось зрение. Хотя на пути к массовому клиническому применению авторы преодолели множество сложностей, они не сдались, хотя многие другие ученые наверняка бы решили, что это занятие не для них, и лучше они переключатся на решение
В 2008 году в Модене был организован Центр регенеративной медицины Стефано Феррари, и исследование заканчивалось уже там. В 2010 году было опубликовано уже более масштабное исследование (Rama et al., Limbal
Прежде чем метод лечения стало можно массово использовать, ученым пришлось решить довольно много отдельных задач. В частности, выяснилось, что с области лимба есть разные стволовые клетки, и не каждое их соотношение гарантирует успех при трансплантации. В ходе исследования выяснилось, что нужные стволовые клетки могут быть обнаружены по наличию в них белка p63. Этот белок регуляторный, он запускает синтез в клетке определенных белков и необходим для поддержания клеток в состоянии стволовости. Клетки, в которых этот белок был, оказались необходимы для восстановления зрения. Когда среди пересаживаемых клеток было больше 3% клеток, несущих белок, 78% трансплантаций вели к восстановлению зрения, а, когда меньше 3% — около 11%.
Еще одна задача, на решение которой ушло много времени — это создание подложки для выращивания клеток, обладающей необходимыми свойствами. Первые подложки были слишком хрупкими, и с трансплантацией возникали проблемы.
Примечательна эта история не только с научной точки зрения (с научной точки зрения вопрос решен публикацией 2010 года), а как пример взаимодействия науки и общества.
Здесь науке было что предложить обществу, но вся отрасль находится на такой ранней ступени развития, что механизмы такого предложения вообще не разработаны. Общество хочет быть уверено, что научная новинка и безопасна, и полезна. В 2007 году в Евросоюзе были приняты новые стандарты для разрабатываемых терапевтических методов. Последние семь лет авторы работы провели в непрерывном общении с соответствующими регулирующими органами, доказывая, что их методики безопасны и воспроизводимы — то есть всех больных лечат одинаково. Итальянские ученые — первые, кому удалось преодолеть всю эту процедуру и получить одобрение регулирующих органов на использование своих клеточных технологий. Возможно, их последователям будет легче, но даже для обычных только что разработанных лекарств, представляющих из себя химическое вещество, этот процесс может занять десяток лет.
Хотя Италия и в минимальной степени по европейским меркам поддерживает развитие биотехнологической отрасли, там время от времени происходят довольно знаковые для отрасли события, как положительные, так и отрицательные.
В Италии разворачивается (и, мы надеемся, вошел в заключительную фазу) громкий скандал вокруг фонда Стамина (Stamina Foundation). Фонд был основан доктором Давидом Ваннони в 2009 году и занимался, по сути, шарлатанством, предлагая (естественно, не бесплатно) стволовые клетки как лекарство от всех болезней. В основном они лечили от нейродегенеративных заболеваний мезенхимальными стволовыми клетками. Мезенхимальные стволовые клетки легко получить, например, из жировой ткани. Авторы утверждали, что эти клетки превращаются в нейроны и сами встраиваются в нужные места. Ни безопасность, ни даже эффективность их «лекарств» никогда не была доказана, доктор Ваннони никогда не публиковал ничего похожего в рецензируемых журналах. Но у фонда было много сторонников, организовывались даже демонстрации в поддержку.
В 2013 году под действием научной и медицинской общественности итальянское правительство, наконец, инициировало клинические испытания метода, и в августе 2014 года суд города Турина постановил конфисковать оборудование и клетки из лабораторий Стамины.
Другое событие, связанное с биотехнологией и произошедшее в Италии окрашено положительно. В 1992 году здесь состоялись одни из первых клинических испытаний генной терапии врожденного генетически обусловленного иммунодефицита. Дети, рожденные с такой болезнью, вынуждены жить в полной изоляции и почти стерильных условиях. Любая встреча с инфекцией для них чревата смертью. Испытания оказались успешными.
Портал «Вечная молодость» http://vechnayamolodost.ru