Новое лекарство от болезни Альцгеймера предложили ученые из Йельского университета (Kaufman et al., Fyn inhibition rescues established memory and synapse loss in Alzheimer mice). Примечательно в этом лекарстве то, что не такое уж оно и новое — вещество AZD0530 было разработано как лекарство от рака фармацевтическим гигантом «АстраЗенека». Но как лекарство от рака оно не показало никаких вселяющих оптимизм результатов, и было бы забыто, если бы не новый проект NIH.
Национальные институты здоровья (NIH) — основной государственный орган в США, регулирующий биомедицинские исследования. Значительная часть государственного финансирования распределяется ими.
Недавно они запустили проект, дающий второй шанс неработающим лекарствам. Чтобы начались клинические испытания нового лекарства на людях, оно должно оказаться эффективным при лечении животных моделей болезни. Потом нужно получить разрешение контролирующих органов, и можно начинать испытания на людях. Первые стадии клинических испытаний в большей степени посвящены доказательству безопасности лекарства, исследованию возможных побочных эффектов и подбору дозы. В них участвует довольно мало людей, часто не больше десятка добровольцев, но все это занимает не так мало времени. К третьей фазе клинических испытаний число участников в некоторых случаях может достигать нескольких тысяч, но обычно числа гораздо скромнее. Основываясь на результатах третьей фазы, обычно уже принимают решение о допуске препарата на рынок, но исследование продолжается и после.
Иногда понимание того, что препарат неэффективен, приходит уже после выпуска на рынок, и очень часто — как раз во время третьей фазы. К этому моменту на разработку и исследование лекарства потрачено много времени и денег (фармкомпании обычно закладывают эти расходы в цены успешных эффективных препаратов).
Но человеческий организм устроен очень сложно, и это дает лекарствам, оказавшимся неэффективными против
Это не очень редкая ситуация, но такой эффект не так просто обнаружить. В самом деле, нельзя случайно увидеть, что лекарство эффективно против другой болезни, если участники испытаний этой второй болезнью не болеют. То есть нужно, чтобы эффект можно было наблюдать и у здоровых людей (как в случае с силденафилом) или чтобы среди участников испытаний оказались люди, страдающие второй болезнью тоже.
Но
Вещество AZD0530 (саракатиниб) — ингибирует киназы семейства Sfk. Киназы — это регуляторные белки, которые активируют другие белки, фосфорилируя их. Как правило, повышенная активность киназ связана с более быстрым ростом и размножением клеток. Поэтому вышедшие
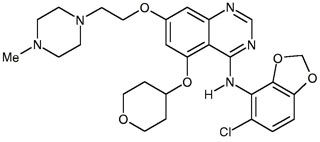
Вообще киназы участвуют во многих клеточных процессах, и к возникновению патологии приводит не сама по себе их активность, а избыточная активность. Избыточная активность киназ (избыточное фосфорилирование
Широко известно, что симптомы болезни Альцгеймера вызываются агрегацией неправильно свернутого белка,
Поэтому авторы работы предположили, что если использовать AZD0530 в качестве ингибитора киназы
Портал «Вечная молодость» http://vechnayamolodost.ru